TUGAS TERSTRUKTUR
1. Menurut Louis de Broglie bahwa elektron mempunyai sifat gelombang sekaligus juga partikel.
Jelaskan keterkaitannya dengan teori mekanika kuantum dan Teori Orbital Molekul ?
Jawab :
Berikut penjelasan keterkaitannya, tentang teori Louis de Broglie dengan teori mekanika kuantum dan teori orbital molekul
Teori atom Louis Broglie
Pada tahun 1924, Louis de Broglie, seorang ahli fisika dari prancis mengemukakan hipotesis tentang
gelombang materi. Gagasan ini adalah timbal balik daripada gagasan partikel
cahaya yang dikemukakan Max Planck. Louis de Broglie meneliti keberadaan
gelombang melalui eksperimen difraksi berkas elektron. Dari hasil penelitiannya
inilah diusulkan “materi mempunyai sifat gelombang di samping partikel”, yang
dikenal dengan prinsip dualitas.
Sifat partikel dan gelombang suatu materi tidak
tampak sekaligus, sifat yang tampak jelas tergantung pada perbandingan panjang
gelombang de Broglie dengan dimensinya serta dimensi sesuatu yang berinteraksi
dengannya. Pertikel yang bergerak memiliki sifat gelombang. Fakta yang
mendukung teori ini adalah petir dan kilat. Kilat akan lebih dulu terjadi
daripada petir. Kilat menunjukan sifat gelombang berbentuk cahaya, sedangkan
petir menunjukan sifat pertikel berbentuk suara.
Louis Victor de Broglie : menyatakan bahwa materi mempunyai dualisme
sifat yaitu sebagai materi dan sebagai gelombang
Hipotesis de Broglie terbukti
benar dengan ditemukannya sifat gelombang dari elektron. Elektron mempunyai
sifat difraksi seperti halnya sinar–X. Sebagai akibat dari dualisme sifat elektron
sebagai materi dan sebagai gelombang, maka lintasan elektron yang dikemukakan
Bohr tidak dapat dibenarkan. Gelombang tidak bergerak menurut suatu
garis, melainkan menyebar pada suatu daerah tertentu.
Partikel yang bergerak memiliki sifat gelombang. Fakta yang mendukung teori ini adalah petir dan kilat. Pernahkan Anda mendengar bunyi petir dan melihat kilat ketika hujan turun? Manakah yang lebih dulu terjadi, kilat atau petir?
Kilat akan lebih dulu terjadi daripada petir. Kilat menunjukan sifat gelombang berbentuk cahaya, sedangkan petir menunjukan sifat pertikel berbentuk suara. Hipotesis de Broglie dibuktikan oleh C. Davidson an LH Giermer (Amerika Serikat) dan GP Thomas (Inggris).
Partikel yang bergerak memiliki sifat gelombang. Fakta yang mendukung teori ini adalah petir dan kilat. Pernahkan Anda mendengar bunyi petir dan melihat kilat ketika hujan turun? Manakah yang lebih dulu terjadi, kilat atau petir?
Kilat akan lebih dulu terjadi daripada petir. Kilat menunjukan sifat gelombang berbentuk cahaya, sedangkan petir menunjukan sifat pertikel berbentuk suara. Hipotesis de Broglie dibuktikan oleh C. Davidson an LH Giermer (Amerika Serikat) dan GP Thomas (Inggris).
Penjelasan mengenai radiasi
cahaya juga telah dikemukakan oleh Max Planck pada tahun 1900. Ia mengemukakan teori
kuantum yang menyatakan bahwa atom dapat memancarkan atau menyerap
energi hanya dalam jumlah tertentu (kuanta). Jumlah energi yang dipancarkan
atau diserap dalam bentuk radiasi elektromagnetik disebut kuantum.
Adapun besarnya kuantum dinyatakan dalam persamaan berikut:
E = energi radiasi (Joule =
J)
h = konstanta Planck (6,63 x 10-34 J.s)
c = cepat rambat cahaya di ruang hampa (3 x 108 ms-1)
l = panjang gelombang (m)
h = konstanta Planck (6,63 x 10-34 J.s)
c = cepat rambat cahaya di ruang hampa (3 x 108 ms-1)
l = panjang gelombang (m)
Dengan Teori Kuantum, kita dapat mengetahui besarnya radiasi yang dipancarkan maupun yang diserap. Selain itu, Teori Kuantum juga bisa digunakan untuk menjelaskan terjadinya spektrum atom.
MODEL ATOM MEKANIKA GELOMBANG
Hipotesis Louis de Broglie dan azas ketidakpastian dari Heisenberg
merupakan dasar dari model Mekanika Kuantum (Gelombang) yang dikemukakan
oleh ERWIN SCHRODINGER pada tahun1927, yang mengajukan
konsep orbital untuk menyatakan kedudukan elektron dalam atom. Orbital
menyatakan suatu daerah dimana elektron paling mungkin (peluang
terbesar) untuk ditemukan.
Schrodinger sependapat dengan Heisenberg bahwa kedudukan elektron
dalam atom tidak dapat ditentukan secara pasti, namun yang dapat
ditentukan adalah kebolehjadian menemukan elektron pada suatu titik pada
jarak tertentu dari intinya. Ruangan yang memiliki kebolehjadian
terbesar ditemukannya elektron disebut Orbital.
Dalam mekanika kuantum, model orbital atom digambarkan menyerupai
“awan”. Beberapa orbital bergabung membentuk kelompok yang disebut Subkulit.
Persamaan gelombang ( Ψ= psi) dari Erwin Schrodinger menghasilkan
tiga bilangan gelombang (bilangan kuantum) untuk menyatakan kedudukan
(tingkat energi, bentuk, serta orientasi) suatu orbital, yaitu: bilangan
kuantum utama (n), bilangan kuantum azimut (l) dan bilangan kuantum
magnetik (m)
TEORI ORBITAL MOLEKUL
Sifat
simetri dan energi relatif orbital atom menentukan bagaimana mereka
berinteraksi untuk membentuk orbital molekul. Orbital molekul ini kemudian
diisi dengan elektron tersedia sesuai dengan aturan yang sama yang digunakan
untuk orbital atom, dan energi total elektron dalam orbital molekul
dibandingkan dengan total awal energi elektron dalam orbital atom.
Jika
energi
total elektron dalam molekul orbital kurang dari dalam orbital atom,
molekul stabil dibandingkan dengan atom; jika tidak, molekul tidak
stabil dan
senyawa tidak terbentuk. Teori orbital molekul mengkombinasikan
kecenderungan atom untuk mencapai keadaan oktet dengan sifat-sifat
geombangnya, menempatkan elektron-elektron pada suatu tempat yang
disebut orbital. Menurut teori orbital molekul, ikatan kovalen dibentuk
dari kombinasi orbital-orbital atom membentuk orbital molekuler; yaitu
orbital yang dimiliki oleh molekul secara keseluruhan. Seperti orbital
atom, yang menjelaskan volume ruang di sekeliling inti atom di mana
elektron mungkin ditemukan, orbital molekuler menjelaskan volume ruang
di sekeliling molekul di manaelektron mungkin ditemukan.
Orbital molekuler juga memiliki bentuk ukuran dan energi yang spesifik.
Mari kita lihat pada contoh pertama kita dalam molekul hidrogen (H2). Orbital 1s dari satu atom hidrogen mendekati orbital 1s dari
atom hidrogen kedua, kemudian keduanya melakukan overlap orbital.
Ikatan kovalen terbentuk ketika dua orbital s mengalami overlap, disebut
dengan ikatan sigma (σ). Ikatan sigma berbentuk silindris simetris , elektron dalam ikatan ini terdistribusi secara simetris/ berada di tengah antara dua atom yang berikatan.
2. Bila absorpsi sinar UV oleh ikatan rangkap menghasilkan promosi elektron ke orbital yang
berenergi lebih tinggi.Transisi elektron manakah memerlukan energi terkecil bila
sikloheksena berpindah ke tingkat tereksitasi ?
Jawab :
Spektrofotometri UV merupakan salah satu metode analisis yang dilakukan dengan panjang gelombang 100-400 nm atau 595–299 kJ/mol.Sinar ultraviolet atau sinar ungu terbagi menjadi dua jenis yaitu Ultraviolet jauh dan Ultaviolet dekat Ultraviolet jauh memiliki rentang panjang gelombang ± 10 – 200 nm, sedangkan ultraviolet dekat memiliki rentang panjang gelombang ± 200-400 nm. Cahaya UV tidak bisa dilihat oleh manusia, namun beberapa hewan, termasuk burung, reptil dan serangga seperti lebah dapat melihat sinar pada panjang gelombang UV.
Energi yang
dimiliki sinar UV mampu menyebabkan perpindahan elektron (promosi
elektron) atau yang disebut transisi elektronik. Transisi elektronik
dapat diartikan sebagai perpindahan elektron dari satu orbital ke
orbital yang lain.
Disebut
transisi elektronik karena elektron yang menempati satu orbital dengan
energi terendah dapat berpindah ke orbital lain yang memiliki energi
lebih tinggi jika menyerap energi, begitupun sebaliknya elektron
dapatberpindah dari orbital yang memiliki energi lebih rendah jika
melepaskan energi. Energi yang diterima atau diserap berupa radiasi elektromagnetik.
Berdasarkan
mekanika kuantum transisi elektronik yang dibolehkan atau tidak
dibolehkan (terlarang) disebut kaidah seleksi. Berdasarkan kaidah
seleksi, suatu transisi elektronik termasuk:
1. Transisi diperbolehkan bila nilai ε sebesar 103 sampai 106.
2. Transisi terlarang bila nilai ε sebesar 10-3 sampai 103.
Dalam satu molekul terdapat dua jenis orbital yakni Orbital Ikatan (bonding orbital) dan Orbital Anti-ikatan (antibonding orbital). Orbital
ikatan di bagi menjadi beberapa jenis yakni orbital ikatan sigma (σ, =
ikatan tunggal) dan orbital phi (π, = ikatan rangkap), sedangkan orbital
nonikatan berupa elektron bebas yang biasanya dilambangkan dengan n. Orbital nonikatan umumnya terdapat pada molekul-molekul yang mengandung atom nitrogen, oksigen, sulfur dan halogen.
Gambar di bawah ini (Gambar a dan b) menunjukkan OM yang dibentuk dari kombinasi 2 orbital atom 1s dan energi relatif yang akan dimiliki elektron dalam masing-masing elektron miliki dalam
orbital.
Orbital molekul ikatan memiliki energi yang lebih rendah dan kestabilan yang lebih rendah dibandingkan orbital-orbital atom pembentuknya.
Orbital molekul antiikatan memiliki energi yg lebih tinggi dan kestabilan yang
lebih rendah dibandingkan orbital-orbital atom pembentuknya.
Transisi
elektronik atau perpindahan elektron dapat terjadi dari orbital ikatan
ke orbital anti-ikatan atau dari orbital non-ikatan (nonbonding orbital)
ke orbital anti-ikatan. Terjadinya transisi elektronik atau promosi
elektron dari orbital ikatan ke orbital antiikatan tidak menyebabkan
terjadinya disosiasi atau pemutusan ikatan, karena transisi elektronik
terjadi dengan kecepatan yang jauh lebih tinggi dari pada vibrasi inti.
Pada transisi
elektronik inti-inti atom dapat dianggap berada pada posisi yang tepat.
Hal ini dikenal dengan prinsip Franck-Condon. Disamping itu dalam proses
transisi ini tidak semua elektron ikatan terpromosikan ke orbital
antiikatan.
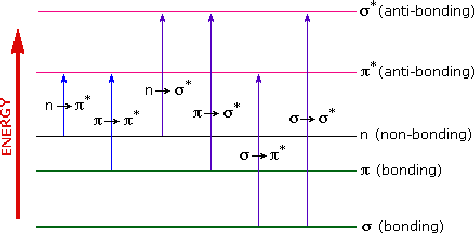
Berdasarkan jenis orbital tersebut maka, jenis-jenis transisi elektronik dibedakan menjadi empat macam, yakni:
1) Transisi σ → σ*
2) Transisi π → π*
3) Transisi n → π*
4) Transisi n → σ*
Keterangan
· σ : senyawa-senyawa yang memiliki ikatan tunggal
· π : senyawa-senyawa yang memiliki ikatan rangkap
· n menyatakan orbital non-ikatan: untuk senyawa-senyawa yang memiliki elektron bebas.
· σ* dan π*
merupakan orbital yang kosong (tanpa elektron), orbital ini akan terisi
elektron ketika telah atau bila terjadi eksitasi elektron atau
perpindahan elektron atau promosi elektron dari orbital ikatan.
Energi yang
diperlukan untuk menyebabkan terjadinya transisi berbeda antara transisi
satu dengan transisi yang lain. Transisi σ ke σ* memerlukan energi
paling besar, sedangkan energi terkecil diperlukan untuk transisi dari n
ke π.
Untuk
memberikan gambaran dan memudahkan pemahaman tentang jenis transisi
beserta perbandingan energi yang diperlukan dapat dilihat pada gambar
berikut:
Pada gambar di
atas transisi dari σ ke π* sebenarnya tidak ada. Transisi demikian dapat
pula terjadi tapi sangat kecil sehingga tidak dapat diamati pada
spektrum atau spektra. Karena bertolak belakang dengan kaidah seleksi.
Pada setiap jenis transisi elektronik yang terjadi, terdapat karakter dan melibatkan energi yang berbeda.
Suatu kromofor dengan pasangan elektron bebas (n) dapat menjalani
transisi dari orbital non-ikatan (n) ke orbital anti-ikatan, baik pada
obital sigma bintang (α*) maupun phi bintang(π*). Sedangkan, kromofor
dengan elektron ikatan rangap (menghuni orbital phi) akan menjalani
transisi dari orbital π ke orbital π*. Demikian seterusnya untuk jenis
transisi yang lain.



















saya rianti nita wulandari hanya sedikit menambahkan
BalasHapusMekanika kuantum adalah cabang dasar fisika yang menggantikan mekanika klasik pada tataran atom dan subatom. Ilmu ini memberikan kerangka matematika untuk berbagai cabang fisika dan kimia, termasuk fisika atom, fisika molekular, kimia komputasi, kimia kuantum, fisika partikel, dan fisika nuklir. Mekanika kuantum adalah bagian dari teori medan kuantum dan fisika kuantum umumnya, yang, bersama relativitas umum, merupakan salah satu pilar fisika modern. Dasar dari mekanika kuantum adalah bahwa energi itu tidak kontinyu, tapi diskrit berupa 'paket' atau 'kuanta'. Konsep ini cukup revolusioner, karena bertentangan dengan fisika klasik yang berasumsi bahwa energi itu berkesinambungan.
Menurut “Louis de Broglie”, elektron bersifat gelombang dan partikel. Ia menyatakan bahwa hipotesis adalah gelombang materi dinyatakan pada tahun 1924. Secara khusus digunakan untuk menjelaskan sebaran intensitas radiasi yang dipancarkan oleh benda hitam. Pada tahun 1905, Albert Einstein menjelaskan efek fotoelektrik dengan menyimpulkan bahwa energi cahaya datang dalam bentuk kuanta yang disebut foton. Pada tahun 1913, Niels Bohr menjelaskan garis spektrum dari atom hidrogen, lagi dengan menggunakan kuantisasi. Pada tahun 1924, Louis de Broglie memberikan teorinya tentang gelombang benda.
Teori-teori di atas, meskipun sukses, tetapi sangat fenomenologikal: tidak ada penjelasan jelas untuk kuantisasi. Mereka dikenal sebagai teori kuantum lama. Frase "Fisika kuantum" pertama kali digunakan oleh Johnston dalam tulisannya Planck's Universe in Light of Modern Physics (Alam Planck dalam cahaya Fisika Modern). Mekanika kuantum modern lahir pada tahun 1925, ketika Werner Karl Heisenberg mengembangkan mekanika matriks dan Erwin Schrödinger menemukan mekanika gelombang dan persamaan Schrödinger. Schrödinger beberapa kali menunjukkan bahwa kedua pendekatan tersebut sama.
terimah kasih.
Terima kasih banyak, saya ucapkan kepada saudari rianti nita wulandari atas penambahan materinya. Semoga dengan ditambahkan materi ini akan lebih lengkap dari pada sebelumnya.
BalasHapusTerima kasih . . .
selamat malam azhabul yamin. saya ingin menambahakan materi blog anda
BalasHapusTransisi elektron dapat diartikan sebagai perpindahan elektron dari satu orbital ke orbital yang lain. Disebut transisi elektron karena elektron yang menempati satu orbital dengan energi terendah dapat berpindah ke orbital lain yang memiliki energi lebih tinggi jika menyerap energi. Dan pada sikloheksana. Pada senyawa senyawa organik tansisi elektronik menimbulkan spektra pada daerah sinar tampak dan sinar UV. Elektron dalam suatu ikatan kovalen tunggal terikat dengan kuat sehingga diperlukan radiasi berenergi tinggi atau panjang gelombang pendek untuk eksitasinya, sedangkan elektron dalam ikatan rangkap dan ganda tiga lebih mudah dieksitasikan keorbital yang lebih tinggi sehingga memerlukan radiasi berenergi lebih rendah.
terima kasih.
Terima kasih banyak, saya ucapkan kepada saudari fitri sulastri atas penambahan materinya. Semoga dengan ditambahkan materi ini akan lebih lengkap dari pada sebelumnya.
BalasHapusTerima kasih . . .
Assalamualikum saudara yamin menurut saya . Jawaban yang di sampaikan sudah sangat baik nudah dimengerti dan sudah cukup banyak penjelasannya dan juga disertakan gambar sehingga pembaca tertarik untuk membacanya . Trimakasih
BalasHapus